Нейробластома
Содержание:
- Филиалы и отделения, в которых лечат опухоли головного и спинного мозга, а также отделы центральной нервной системы
- Причины
- Патогенез и причины развития
- Вам поставили диагноз: опухоль надпочечника?
- Причины
- Лечение
- Общие сведения
- Что такое феохромоцитома?
- Когда женщина превращается в мужчину …
- Патогенез (что происходит?) во время Опухолей надпочечников:
- Лечение
- Лечение
- «Спасибо, что в Омске нас не взяли»
Филиалы и отделения, в которых лечат опухоли головного и спинного мозга, а также отделы центральной нервной системы
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
- Отделение нейроонкологии МНИОИ имени П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий – к.м.н. ЗАЙЦЕВ Антон Михайлович - Отдел лучевой терапии МНИОИ имени П.А. Герцена — филиала ФГБУ «НМИЦ радиологии» Минздрава России
Тел: 495 150 11 22
Заведующий — д.м.н. ХМЕЛЕВСКИЙ Евгений Витальевич - Отделение протонной и фотонной терапии МРНЦ имени А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий – д.м.н. ГУЛИДОВ Игорь Александрович
Тел: 8 (484) 399 31 30
Причины
До настоящего времени причины нейробластомы неясны. Срыв процесса клеточной дифференцировки вероятно может происходить под воздействием эндогенных/экзогенных факторов, при этом экзогенные причины нейробластомы у детей, по-видимому, существенной роли не играют. В качестве ведущей причины развития нейробластомы считаются мутации, приобретенные под влиянием неблагоприятных факторов. Установлена корреляция между развитием нейробластомы и врожденными патологиями иммунитета/аномалиями развития. Наследственная природа нейробластомы по аутосомно-доминантному типу выявляется лишь в 1-2% случаев.
Для этих опухолей характерны: уникальные/специфические молекулярно-генетические характеристики, что проявляется цитогенетически дополнением генетического материала в виде гомогенно окрашенных областей/в форме запятой или утери гетерозиготности короткого плеча первой хромосомы (в виде делеции 1 р). Изменения такого рода достоверно коррелируют с продвинутыми стадиями развития опухоли и плохим прогнозом. Также чрезвычайно важным является факт изменения в опухолевых клетках плоидности ДНК, в связи с чем выделяют гиперплоидию с триплоидным индексом ДНК, для которой характерно благоприятное течение и тетраплоидные формы с неблагоприятным течением. Большое значение имеет и определение экспрессии рецепторов к факторам роста вегетативной НС (нейротрофинам). При этом, высокая вероятность благоприятного прогноза характерна для экспрессии рецептора trk A, в то время как высокая экспрессия trk B коррелирует с неблагоприятным исходом.
Патогенез и причины развития
По мнению некоторых ученых опухоль развивается вследствие воздействия канцерогенных факторов. По их предположению мутация, которая вызывает первоначальное зарождение опухолевых клеток, появляется еще в период эмбрионального развития.
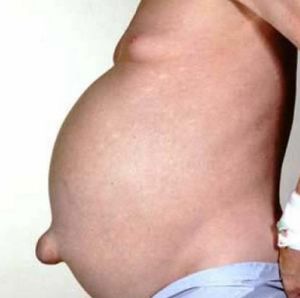
На фото нейробластома забрюшинного пространства у младенца
Нейробласты – недозревшие клетки нервной системы становятся местом, где зарождается нейробластома. При нормальном развитии они впоследствии становятся волокнами нервов и клетками надпочечников.
К моменту рождение остается совсем мало недозревших клеток, из которых вследствие мутации может сформироваться опухоль.
Единственным подтвержденным фактором, который достоверно влияет на риск развития опухоли, является наследственность. Однако риск развития опухоли даже при наличии заболевания у членов семьи не более 1-2%.
Тем не менее, будущим родителям с историей возникновения нейробластомы рекомендуется посетить генетика с целью выяснить какова вероятность ее развития у ребенка.
Хоть врачи и предполагают влияние канцерогенов на мутацию опухоли, не доказано возможного влияния внешних факторов таких как, например, курение матери во время беременности на риск перерождения клеток.
Вам поставили диагноз: опухоль надпочечника?
Наверняка вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать».
Очень часто пациенты чувствуют себя безгранично одинокими в начале пути. Но вы должны понимать — Вы не одни. Мы поможем Вам справиться с болезнью и будем идти с Вами рука об руку через все этапы лечения.
Предлагаем Вашему вниманию краткий, но очень подробный обзор опухоли надпочечника. Его подготовили высоко квалифицированные специалисты онкологическо-урологического отделения НИИ урологии и интервенционной радиологии имени Н.А. Лопаткина к.м.н. Ирина Огнерубова и Павел Пеньков под руководством заведующего отделением к.м.н. Александра Качмазова.
Данная брошюра содержит информацию о диагностике и лечении опухоли надпочечника. Здесь собраны основные методики лечения данного заболевания, в том числе, последние разработки отечественных и зарубежных ученых-онкологов.
Причины
Причины, приводящие к развитию рака средостения, неизвестны. Предполагается, что определенную роль играет воздействие следующих факторов:
- Ионизирующее излучение. В пользу этой теории говорит то, что лимфомы средостения чаще развиваются у людей, проходивших лучевую терапию по поводу лечения онкозаболеваний другой локализации.
- Канцерогенные вещества, которые встречаются в бытовой химии, сельском хозяйстве и промышленных производствах.
- Вирусы Эпштейн-Барра, ВИЧ и др.
- Помимо этого, рак средостения может быть следствием малигнизации изначально доброкачественной опухоли, например, тимомы.
Лечение
Золотым стандартом лечения опухолей головного мозга, злокачественных и доброкачественных новообразований, является метод бескровного дистанционного лечения на радиохирургической системе КиберНож.
В тех случаях, когда лечение нейроцитомы на КиберНоже не представляется возможным, опухоль может быть удалена хирургически или с методом лучевой терапии на линейном ускорителе с функцией IMRT.
До появленния КиберНожа традиционная нейрохирургия, предусматривающая трепанацию черепа и доступ к опухоли головного мозга, была сопряжена с высоким риском развития побочных эффектов. В том числе тяжелых неврологических нарушений. Поэтому тактика лечения предусматривала максимально длительное наблюдение пациента вплоть до того момента, когда неврологические симптомы резко снижали качество его жизни и даже начинали представлять угрозу для жизни.
Поэтому радиохирургическое лечение нейроцитомы на КиберНоже нашло широкое применение в мировой практике.

КиберНож — безоперационное лечение нейроцитомы
Лечение нейроцитомы на КиберНоже
После постановки и подтверждения диагноза на основании проведенных КТ- и МРТ-исследований определяется фактическая форма и пространственное расположение опухоли и окружающих ее важных структур организма. В этой области, форма которой утверждается группой врачей, работающих над созданием индивидуального плана лечения, будет сконцентрирована зона высокой дозы ионизирующего излучения, вызывающего разрушение опухолевых клеток.
При этом здоровые ткани головного мозга, окружающие опухоль мозга, получат безопасную (толерантную) дозу радиации. Это является основным преимуществом радиохирургического лечения на КиберНоже — область высокой дозы излучения формируется из точек пересечения одиночных тонких пучков, которые доставляются из различных положений компактным линейным ускорителем, размещенным на роботизированном манипуляторе КиберНожа.
Курс лечения нейроцитомы на КиберНоже обычно составляет 1-3 сеанса (фракции), каждый из которых длится 15-40 минут, во время лечения пациент удобно располагается на подвижной кушетке, вокруг которой двигается роботизированная «рука»-манипулятор КиберНожа, направляя каждый отдельный пучок излучения из заданных планом лечения положений.
Ограничения подвижности пациента методом анестезии не требуется — небольшие смещения положения заданной зоны доставки во время легких движений пациента (например, при дыхании), корректируются системой слежения КиберНожа, что повышает безопасность и точность лечения. Длительность лечения на КиберНоже (количество сеансов) определяется индивидуально, как и длительность, состав дополнительной терапии и стоимость лечения.
Преимущества КиберНожа
- общее состояние пациента имеет значительно меньшее значение для возможности проведения такого лечения, чем при нейрохирургии;
- радиохирургия на КиберНоже проводится амбулаторно, после завершения сеанса пациент возвращается к привычному распорядку жизни;
- во время сеанса пациент находится в сознании, не требуется анестезия, что снижает риски и стоимость лечения
Siemens Magnetom Sola в Клинике Спиженко
Общие сведения
Нейробластома представляет собой эмбриональную злокачественную опухоль, которая формируется из незрелых клеток (симпатогониев), являющихся предшественниками симпатической нервной системы. Характерна манифестация заболевания в детском возрасте, преимущественно у детей раннего возраста и на ее долю приходится около 80% в возрастной группе детей до 5 лет. Около 40% случаев нейробластом приходится на первый год жизни ребенка, а по мере взросления количество случаев снижается. На момент постановки диагноза средний возраст детей составляет 22 месяца. При этом соотношение мальчиков и девочек составляет 1,2:1.
Преобладание у детей опухолей симпатической НС обусловлено прежде всего особенностями ее развития, поскольку процесс формирования симпатических ганглиев во внутриутробном периоде не заканчивается, а их клеточное строение становится аналогичным взрослым лишь к 5-летнему возрастному периоду. Соответственно высокая напряженность/интенсивность роста и развития симпатической НС создаются условия для опухолевой пролиферации.
Нейробластома может выявляться в любой анатомической области по ходу симпатической нервной цепочки. Наиболее часто встречается нейробластома забрюшинного пространства (в 45% случаев), в области надпочечников (около 30% случаев), в средостении 10-15% и малом тазу — около 3%. Значительно реже развивается в легких, вилочковой железе, почке и еще реже в других анатомических областях, например эстезионейробластома (интраназальная нейробластома). При этом, на момент постановки диагноза около 50% случаев заболевания выявляются признаки метастазирования, преимущественно в регионарные/отдаленные лимфоузлы, кости, кожу, костный мозг, печень, реже в ЦНС и легкие. Метастазирование может осуществляться как гематогенным, так и лимфогенным путем.
Согласно гистологическим данным, выделяются, собственно, нейробластома и гистологически относительно доброкачественный вариант новообразования — ганглионейробластома, а также доброкачественный вариант опухоли — ганглионеврома. То есть, ганглионейробластома, как вариант новообразования занимает промежуточное положение между недифференцированной нейробластомой и дифференцированной ганглионевромой.
Биологические особенности нейробластомы
Для нейробластомы характерны ряд специфических биологических характеристик ее поведения, которые другим злокачественным опухолям не свойственны:
- Способность опухоли к спонтанной регрессии. Хорошо известны примеры в клинической практике, когда у детей грудного возраста с выраженной клинической симптоматикой (нейробластома 4 стадии) происходила инволюция злокачественного процесса. В тоже время, у детей до года с первой стадией регрессии опухоли не наступает. И до настоящего времени какой-либо маркер, вызывающий перелом в течении от прогрессии к регрессии не определен.
- Способность нейробластомы к дифференцировке («созреванию»). При культуральном исследовании установлено, что в процессе культивирования культура клеток из агрессивно растущей опухоли приобретала характеристики дифференцирующейся нервной ткани. И этот процесс способны индуцировать различные агенты (папаверин, некоторые цитостатики, ретиновая кислота) in vitro. Но в тоже время до сегодняшнего дня данных об индукции процесса дифференцировки in vivo нет.
- Способность нейробластомы к агрессивному стремительному развитию и быстрому метастазированию. Принято считать, что ведущими факторами (маркерами) прогрессии, являются генетические нарушения (делеция 1 пары хромосомы).
В настоящее время нейробластома является наиболее частой и «проблемной» опухолью в онкологии детского возраста с непредсказуемым биологическим поведением, в большинстве — с неизвестными факторами риска, участвующими в этиопатогенезе, сложностью установления на ранних стадиях заболевания диагноза и отсутствием эффективного лечения при запущенных стадиях.
Что такое феохромоцитома?
Феохромоцитома – опухоль из хромафинных клеток мозгового слоя надпочечников, продуцирующих катехоламины (адреналин, норадреналин). Частота встречаемости феохромоцитомы составляет 2-8 случаев на 1 млн населения в год. Феохромоцитому обнаруживают у 0,1-1% пациентов с артериальной гипертензией. Одинаково часто заболевают мужчины и женщины в возрасте от 20 до 50 лет. Большинство феохромоцитом спорадические (случайные), лишь у 10% больных отмечают наследственные заболевания.
Клинические проявления связаны с продукцией избыточного уровня катехоламинов, а основным является повышение артериального давления (АД) (систолического и диастолического). Возможны постоянное, стойкое повышение артериального давления, напоминающее по течению гипертоническую болезнь или гипертонические кризы, при этом в межкризовые периоды АД нормализуется. Продолжительность кризов от нескольких минут до нескольких часов. Повышение АД сопровождается головной болью, чувством страха, потливостью, побледнением или покраснением кожных покровов, судорогами, одышкой, нарушением зрения и др. Резкое повышение АД может наблюдаться спонтанно или быть спровоцировано различными событиями (физическое, психическое напряжение).
Важное место в диагностике, наряду с традиционнами инструментальными методами обследования, принадлежит лабораторным тестам. У больных с феохромоцитомой и стойким повышением АД, как правило, повышены уровни катехоламинов в крови и моче
Определение концентрации гормонов позволяет подтвердить или исключить заболевание.
Когда женщина превращается в мужчину …
Андростерома — опухоль коры надпочечника, продуцирующая избыточное количество андрогенов. Эти достаточно редкие опухоли (1-3% всех новообразований надпочечников) выявляются во всех возрастных группах, но преимущественно у женщин в возрасте до 40 лет. Редкость обнаружения андростером у мужчин может быть связана с меньшей отчетливостью у них признаков вирилизации; часть этих новообразований имитирует гормонально-неактивные опухоли надпочечников.
Симптоматика при андростероме характеризуется быстрой вирилизацией. У девочек отмечаются рост волос на лобке по мужскому типу, увеличение клитора в пубертатный период, отсутствие роста молочных желез и менструаций, усиленное развитие мускулатуры, появление мужского тембра голоса. У мальчиков наблюдаются признаки преждевременного полового созревания.
У женщин уменьшается подкожный жировой слой, становится более рельефной мускулатура, увеличивается ее масса, грубеет и становится низким голос. Наблюдается рост волос на лице, теле и конечностях, выпадают волосы на голове. Менструации вскоре прекращаются. Уменьшаются молочные железы. Значительно увеличивается клитор. В большинстве случаев отмечается повышенное либидо.
Решающее значение при постановке диагноза андростеромы имеют данные КТ и МРТ. УЗИ помогает выяснить топографические взаимоотношения опухоли с почкой, аортой, нижней полой веной, селезенкой и печенью, что необходимо для выбора оперативной тактики.
Лечение андростером только оперативное — удаление пораженного опухолью надпочечника. В случае успешного удаления опухоли симптомы заболевания довольно быстро подвергаются обратному развитию. В запущенных случаях и у пациентов с неоперабельными опухолями или отдаленными метастазами лечение симптоматическое.
Прогноз при ранней диагностике и своевременном оперативном лечении доброкачественных андростером благоприятный. Однако довольно часто дети остаются низкорослыми вследствие раннего закрытия зон роста. При злокачественных андростеромах и наличии отдаленных метастазов прогноз неблагоприятный.
Патогенез (что происходит?) во время Опухолей надпочечников:
Надпочечники вырабатывают гормоны, регулирующие обмен веществ, артериальное давление, а также женские и мужские половые гормоны. Так что основные проявления опухоли надпочечника связаны с действием того гормона, который она вырабатывает в избыточном количестве.
Различают первичныеи метастатические опухоли надпочечников
Первичные опухоли надпочечниковотносятся к одному из важных и трудных в диагностическом и лечебном плане разделов клинической онкологии. Эти заболевания объединяют группу различных вариантов опухолей, в число которых входят и гормональноактивные опухоли надпочечников. Общепринято классифицировать опухоли надпочечников на доброкачественные и злокачественные
Это имеет важное практическое значение относительно прогноза заболевания, так как хирургическое удаление доброкачественной опухоли ведет к полному выздоровлению, тогда как прогноз при злокачественных новообразованиях сомнителен. При этом морфологические признаки злокачественности опухолей надпочечников дискутируются до настоящего времени
Если до недавнего времени считалось, что опухоли надпочечников являются редкой патологией и составляют не более 0,6% всех злокачественных опухолей, то в настоящее время благодаря широкому внедрению в повседневную клиническую практику таких неинвазивных, но весьма информативных методов диагностики, как УЗИ, КТ, МРТ, резко возросло число обнаруживаемых новообразований в забрюшинном пространстве. Часть таких образований локализуется в надпочечнике и в большинстве случаев является опухолями, исходящими либо из коркового, либо мозгового его слоев.
Надпочечники имеют сложное гистологическое строение и состоят из двух отличающихся друг от друга в эмбриологическом и морфологическом отношении слоев – коркового и мозгового.
В отечественной и зарубежной литературе существует большое количество различных классификаций опухолей надпочечников. В настоящее время в основном используется классификация, основанная на гистогенетическом принципе:
-
Эпителиальные опухоли коры надпочечников:
- аденома,
- карцинома.
-
Мезенхимальные опухоли:
- миелолипома,
- липома,
- фиброма,
- ангиома.
-
Опухоли мозгового слоя надпочечников:
- феохромоцитома,
- нейробластома,
- ганглиома,
- симпатогониома.
Одной из наиболее удобных клинико–морфологических классификаций является классификация, предложенная Micali F. et al. (1985).
Злокачественные опухоли надпочечников нуждаются в клинической классификации по стадиям. Одними из первых пытались решить эту задачу Macfarlan D.A. в 1958 году, а затем Sullivan M. в 1978, который модифицировал классификацию Macfarlan D.A. по системе TNM:
- T1 – относительно малые размеры опухоли – до 5 см.
- T2 – относительно большие размеры опухоли – более 5 см.
- T3 – любой размер опухоли с местной инвазией в окружающие ткани.
- T4 – любой размер опухоли с прорастанием в окружающие органы, печень, почки, поджелудочную железу, нижнюю полую вену.
- N0 – регионарные лимфатические узлы не увеличены.
- N1 – имеются метастазы в парааортальные и паракавальные лимфатические узлы.
- N2 – имеется поражение лимфатических узлов других локализаций.
- M0 – нет отдаленных метастазов.
- M1 – есть отдаленные метастазы.
- Стадия I – T1N0M0
- Стадия II – T2N0M0
- Стадия III – T1N1M0, T2N1M0, T3N0M0
- Стадия IV – T4N2M0, T4N2M1.
Однако данная классификация нуждается в совершенствовании и не находит широкого применения в лечебной практике. Чаще всего используется классификация, предложенная О.В. Николаевым (1963), согласно которой опухоли делятся на следующие виды: кортикостерома, андростерома, кортикоандростерома, альдостерома, кортикоэстрома и комбинированные опухоли. Каждая из них может быть доброкачественной или злокачественной.
Лечение
При планировании лечения используются группы риска. К факторам, определяющим группу риска, относятся: возраст, стадия, гистологические характеристики опухоли, хромосомный набор опухолевых клеток, индекс ДНК.
Лечение комплексное, включающее (в случае резектабельности опухоли) ее радикальное хирургическое удаление/удаление максимального объема опухолевой ткани, что позволяет провести гистологическую верификация диагноза первичной опухоли; химиотерапию и лучевую терапию. Полное иссечение опухоли выполняется лишь при условии низкого риска развития хирургических осложнений.
Для большинства детей с нейробластомой химиотерапия — это основной метод лечения. При проведении ХТ широко используются такие препараты как Доксорубицин, Циклофосфан, Этопозид, Циклофосфамид, Винкристин, Цисплатин, Карбоплатин, Циклофосфамид, Топотекан. Режим ХТ определяется группой риска пациента и эффективностью проводимой химиотерапии. На 1-2 стадии операции предшествует неоадъювантная химиотерапия, а на 3-4 стадии проводится высокодозовая полихимиотерапия и/или с трансплантацией периферических стволовых клеток.
Лучевое терапия назначается при недостаточной эффективности ХТ/нерадикальном удалении первичной опухоли, а также при наличии неоперабельной первичной местно-распространенной опухоли или метастазов, слабо реагирующих на химиотерапевтические препараты. Назначение ЛТ больным решается в каждом случае индивидуально, а областью облучения является остаточная опухоль + граница 1-2 см. Дозы ЛТ определяются величиной остаточной опухоли и возрастом ребенка (тотальная доза от 21 до 40 Гр).
Доктора
специализация: Онколог / Хирург
Байчорова Земфира Узеировна
6 отзывовЗаписаться
Подобрать врача и записаться на прием
Лекарства
Доксорубицин
Циклофосфан
Цисплатин
Этопозид
Карбоплатин
Циклофосфамид
Винкристин
Химиопрепараты (Доксорубицин, Циклофосфан, Этопозид, Циклофосфамид, Винкристин, Цисплатин, Карбоплатин, Циклофосфамид, Топотекан).
При нерезектабельных опухолях может проводится биопсия опухоли для гистологического исследования, а также определения делеций 1 хромосомы/амплификации гена N-myc.
Лечение
Методы лечения рака средостения определяются гистологическим типом новообразования, его локализацией и размерами.
Хирургическое лечение
Хирургическое удаление новообразования является ключевым методом лечения опухолей средостения нелимфогенного происхождения. Во время операции удаляются все злокачественные ткани, лимфоузлы и жировая клетчатка.
Сложность хирургического лечения заключается в том, что в данной анатомической зоне располагаются жизненно важные органы, магистральные кровеносные сосуды и нервные стволы. Поэтому в стремлении радикального удаления опухоли приходится проводить сложные комбинированные операции с резекцией и пластикой этих органов (перикард, легкие, кровеносные сосуды).
При обнаружении значительной исходной опухолевой инвазии, лечение начинают с неоадъювантной химио-, лучевой или химиолучевой терапии. После проведения нескольких курсов проводят повторное обследование и решаю вопрос возможности выполнения радикальной операции. При планировании операции, необходимо учитывать рубцовые изменения, возникающие из-за облучения.
В ряде случаев проводятся паллиативные операции — резекции опухоли. Они призваны устранить компрессию органов средостения и предотвратить развитие осложнений. После таких вмешательств лечение продолжается посредством химио- или лучевой терапии.
Химиотерапия
Химиотерапия является основным методом лечения лимфогенных опухолей (лимфом) средостения. Она применяется в неоадъювантном и адъювантном режимах. В первом случае, ХТ преследует цель уменьшить размер новообразования и перевести его в резектабельное состояние, во втором — уничтожить оставшиеся злокачественные клетки и предотвратить рецидив.
Помимо этого, химиотерапия применяется в качестве поддерживающего лечения при нерезектабельных опухолях. В этом случае она проводится для замедления опухолевого роста, облегчения состояния больного и продления его жизни.
Лучевая терапия
Лучевая терапия используется в рамках комбинированного лечения радиочувствительных опухолей (тератомы, тимомы и др). Дооперационному облучению подлежат опухоли с инвазией в окружающие ткани. Такое лечение позволит уменьшить объем опухолевой массы и перевести ее в операбельное состояние.
Послеоперационная лучевая терапия назначается при некоторых видах рака средостения, которые являются чувствительными к облучению. Это может быть макроскопически остаточная опухоль, которую невозможно, по каким-либо причинам, удалить во время операции (резекция опухоли), или при наличии злокачественных клеток в краях отсечения, обнаруженных во время срочного морфологического исследования.
Также облучение проводится в рамках паллиативного лечения, оно позволяет уменьшить размер новообразования, устранить сдавление внутренних органов и облегчить состояние больного.
Прогноз и профилактика
Прогноз заболевания будет определяться гистологическим типом новообразования, его стадией и возможностью проведения радикального лечения. Больные после окончания лечения рака средостения находятся под наблюдением врачей с целью своевременного выявления рецидива или прогрессирования заболевания.
Запись на консультацию круглосуточно
+7 (495) 151-14-53+7 (861) 238-70-54+7 (812) 604-77-928 800 100 14 98
«Спасибо, что в Омске нас не взяли»
Центр онкологии им. Петрова, Санкт — Петербург
Лера стала частой гостьей больниц, когда в возрасте одного года переболела менингоэнцефалитом. Когда девочке было три года, у неё в забрюшинном пространстве нашли опухоль, которую биопсия определила как раковую. Родители были в шоке – ведь, пока ждали обследования, анализ крови на онкомаркеры у ребёнка взяли. Анализ был чистый.
Потом было несколько лет поездок между родным Омском и Москвой и два рецидива. В Омске девочке дважды начинали капать химиотерапию.
В первый раз лечение прервали в середине второго курса, – критически упали показатели крови. Всего тогда удалось пройти пять курсов из положенных по протоколу шести. Но на несколько месяцев ребёнок ушёл в ремиссию. Во второй раз кровь «завалилась» снова в середине второго курса, а опухоль на лечение не реагировала.
Позже девочку прооперировали в Москве, но положенное при её диагнозе послеоперационное лечение проводить не стали — приехавшая в больницу с весом 18 килограммов, при выписке малышка весила 11. Когда через год рак вернулся снова, от лечения в Омске врачи родителей отговорили, а в Москве в это время был карантин.
«Знаете, я им за это благодарна», — говорит Мария. — «Если бы в Омске нас просто опять взяли на неэффективное лечение, я бы сейчас с вами не разговаривала».
А тогда начался поиск. Родители другого ребёнка, который тоже когда-то лечился в Омском отделении детской онкологии, рассказали Марии, что новый протокол лечения нейробластомы есть в центре Петрова в Санкт-Петербурге.
В перевязочной. Светлана Кулева, доктор медицинских наук, заведующая отделением химиотерапии и комбинированного лечения злокачественных опухолей у детей НМИЦ онкологии имени ПетроваКомментирует Светлана Кулева, доктор медицинских наук, заведующая отделением химиотерапии и комбинированного лечения злокачественных опухолей у детей НМИЦ онкологии имени Петрова:
— В Центре онкологии им. Петрова чаще всего попадают дети из группы высокого риска – со сложными формами нейробластом. Для лечения мы используем принятый в мире протокол:
Сначала пациенту назначают шесть курсов полихимиотерапии. Затем следует закрепление результатов лечения – два курса высокодозной химиотерапии с пересадкой пациенту стволовых клеток его собственного костного мозга. Такая мера позволяет уничтожить одиночные раковые клетки, которые остались в организме после первой стадии лечения.
Тандемная (двойная) трансплантация, которую используют в НМИЦ, увеличивает шансы пациента на полное выздоровление до 60-70%.
Завершают лечение 2-5 курсов иммунотерапии.
В России тандемная трансплантация костного мозга при нейробластоме используется только в Центре онкологии им. Петрова, другие клиники используют только одиночную трансплантацию без последующего перехода к иммунотерапии. В то же время в США сейчас обсуждается целесообразность трипл-тандемной (тройной) трансплантации при этом заболевании.