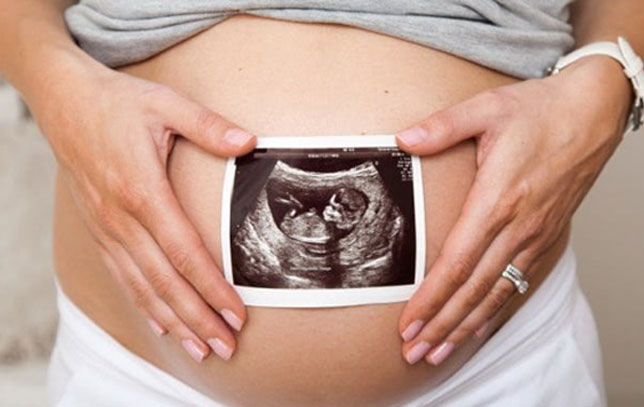
Скрининг наследственных заболеваний плода
Содержание:
- Виды скрининга
- Клинический скрининг рака молочной железы
- 1.Общие сведения
- Профилактика аномалий развития плода
- Как делают скрининг рака шейки матки?
- Что такое скрининг рака шейки матки?
- Методы визуализации плода
- Заболевания ЖКТ, проявляющиеся рвотой желчью
- Спорный скрининг
- Пренатальный скрининг в I триместре
- Пренатальная диагностика
- Подбор дизайна для одной возрастной группы и для разных возрастов
- Исследование мочи по НЕЧИПОРЕНКО
- В каких случаях необходим скрининг во втором триместре беременности
- Как скрининги помогают снизить риск смерти из-за рака молочной железы?
- Нужен ли скрининг, если нет симптомов
- Что делать, если результаты скрининга оказались положительными
- Когда нужно проводить первый скрининговый тест?
Виды скрининга
- Массовый скрининг (Mass S.) просто означает скрининг всего населения.
- Сложный или многомерный скрининг (Multiple or multiphasic S.) подразумевает использование различных скрининговых тестов одномоментно.
- Профилактический скрининг (Prescriptive S.) нацелен на раннее выявление у видимо здоровых людей болезней, контроль над которыми может быть более успешным в случае их выявления на ранней стадии. Пример: маммография для выявления рака молочной железы. Характеристики скринингового теста включают в себя правильность, предполагаемое число выявленных случаев, точность, воспроизводимость, чувствительность, специфичность и достоверность. (См. также: выявляемый доклинический период, измерения.)
- Избирательный скрининг — проводится в отсутствие симптомов, но при наличии одного или более факторов риска развития искомого заболевания, например указаний на заболевания ближайших родственников, особенностей образа жизни или принадлежности обследуемого к популяции с высокой распространенностью соответствующего заболевания
- Генетический скрининг (GENETIC SCREENING) — использование методов молекулярной биологии для выявления мутаций, которые присутствуют у человека и повышают риск развития заболевания, например, генов BRCA1 и BRCA2, значительно повышающих риск развития рака молочной железы и яичников у женщин. При генетическом скрининге могут возникнуть этические проблемы, например, при извещении людей о наличии у них повышенного риска болезни, эффективного лечения которой не существует. Также могут возникнуть проблемы, если результат диагностики способен привести к проблемам с трудоустройством и страхованием.
- Систематический (безвыборочный) скрининг – проводится всем лицам в определенной популяции, например, ультразвуковой скрининг хромосомной патологии, который проводится в первом триместре беременности. Популяцией для данного скрининга являются все без исключения беременные женщины.
- Выборочный скрининг – проводится среди лиц подвергающихся воздействию определенных факторов риска, способных вызвать то или иное заболевание. Примером такого скрининга является исследование медицинских работников на заболеваемость гепатитами В и С, ВИЧ, сифилис, т.к. представители данных профессий контактируют с биологическими жидкостями потенциально больных людей и, соответственно, имеют повышенный риск заражения данными инфекционными болезнями.
Клинический скрининг рака молочной железы
Клиническое обследование проводится врачом в клинике. Эту процедуру рекомендуется регулярно проходить всем женщинам, чей возраст превышает 40 лет. Кроме визуального осмотра и пальпации молочных желез врач может выдать направление на различные диагностические процедуры, при помощи которых можно получить более объективную информацию о состоянии здоровья женщины. К ним относятся маммография, УЗИ молочной железы, биопсия, МРТ и др.
Отдельно стоит сказать об анализах на онкомаркеры рака молочной железы. Применять их в качестве скрининга не совсем показательно и оправдано. Такой анализ имеет смысл при уже выявленном опухолевом процессе. Онкомаркеры помогут отследить ответ на лечение, оценить динамику течения заболевания, но для раннего выявления рака молочной железы они не применяются.
1.Общие сведения
В современной неврологии одной из острых и актуальных проблем, для которой существуют пока лишь паллиативные решения, остается группа спинальных мышечных атрофий (СМА, SMA). Речь идет о наследственных заболеваниях, при которых из-за дефекта одного из генов изначально нарушен механизм питания т.н. моторных нейронов спинного мозга – нервных клеток, отвечающих за сократительную активность мускульных структур организма, – что приводит к постепенному их отмиранию.
К счастью, такая патология достаточно редка, однако среди наследственных заболеваний она является одной из наиболее часто встречаемых. Статистические данные по спинальной мышечной атрофии в различных источниках варьируют (примерно один случай на 6-8 тыс). Достоверно известно, что вероятность рождения больного ребенка при носительстве сбойного гена обоими родителями составляет 1/4 (25%); установлено также, что в случае «запуска» атрофического процесса с самого рождения шансы дожить до двухлетнего возраста не превышают 50%. Однако СМА может начаться в любом возрасте, обычно в интервале 20-50 лет.
Выделяют четыре типа спинальной мышечной атрофии. Синдром Кеннеди (спинобульбарная мышечная атрофия, СБМА) представляет собой взрослую смешанную форму, имеющую ряд отличительных особенностей. В частности, СБМА чаще встречается и протекает тяжелее у мужчин, чем у женщин; это связано с тем, что дефектный ген находится в Х-хромосоме.
Профилактика аномалий развития плода
Для уменьшения риска аномалий развития нервной трубки плода рекомендуют употребление фолиевой кислоты. Потребность небеременных женщин репродуктивного возраста в фолиевой кислоте составляет 0,4 мг фолатов в день. В случае рождения в анамнезе детей с недостатками нервной трубки, пациенткам рекомендуют прием фолиевой кислоты в дозе 4 мг / день по меньшей мере за 3 мес до запланированного оплодотворения.
Риск пороков развития плода у пациенток с инсулинозависимым сахарным диабетом (пороков сердца и нервной трубки) можно уменьшить при условии достижения оптимального контроля уровня глюкозы в крови до наступления беременности.
Как делают скрининг рака шейки матки?
Для проведения скрининга берут мазок с поверхности слизистых оболочек шейки матки. Цель этой процедуры – получение образца клеток шеечного эпителия
Важно, чтобы в образце присутствовали клетки цилиндрического и плоского типа. Чаще всего рак шейки развивается в месте соприкосновения этих клеток
Поэтому мазок (соскоб) для скрининга обычно берут на стыке цилиндрического и плоского эпителия.
Скрининг проходит в 2 этапа:
- Взятие биоматериала
- Исследование клеточного образца
Получение материала на анализ
Мазок берут во время гинекологического осмотра. Сначала врач осматривает цервикальный канал в зеркалах. Далее в просвет шейки вводят специальный шпатель в виде щеточки. Поворачивая его по часовой стенке, гинеколог аккуратно снимает верхний слой слизистой оболочки. Он состоит из цервикальной слизи и эпителиальных клеток.
Во время забора мазка пациентка не ощущает сильной боли. Возможен лишь легкий дискомфорт. Это связано с небольшим количеством нервных окончаний в тканях шеечного канала.
После выведения щеточки из просвета влагалища, ее головку (с клеточным материалом) отделяют от ручки и помещают в специальный раствор. Этот метод называется жидкостная цитология. Он позволяет стабилизировать и лучше сохранить образец материала. Далее образцы направляются на анализ в лабораторию.
Исследование клеточного образца
В лаборатории мазок переносят на предметное стекло и окрашивают специальными красителями. Чаще всего для этого используется методика Папаниколау. После окрашивания образца его исследуют под оптическим микроскопом.
Цель цитологического исследования – оценка строения и количества клеток шейки матки. В поле зрения лаборанта размер, форма, аномалии строения клеточных структур. Также под микроскопом могут быть заметны частицы возбудителей инфекционных болезней. Обнаружение атипичных клеток говорит о развитии злокачественного процесса.
Если образец клеток был правильно взят и подготовлен, цитология позволяет определить такие патологии:
- воспаления;
- дисплазии;
- доброкачественные опухоли;
- рак шейки матки.
Дополнительно мазок обязательно исследуют на ВПЧ. Тест на вирус папилломы человека проводят по методике, сертифицированной в странах ЕС и России. В образце определяют 12 типов ВПЧ (все онкогенные типы). Отдельно проводится более чувствительный анализ на ВПЧ 16 и 18 типов, которые чаще всего вызывают рак шейки матки.
Вирус папилломы в мазке выявляют методом ПЦР-диагностики. Метод основан на обнаружении ДНК вируса в материале пациентки. Участки ДНК выделяют из образца и многократно копируют. Удлиненные генетические цепочки сравнивают с образцами. Метод ПЦР дает 100% точный ответ на вопрос о заражении ВПЧ и типе вируса.
Что такое скрининг рака шейки матки?
Основная цель проведения этого исследования – раннее выявление предраковых состояний шейки. Эти процессы предшествуют онкологии и успешно поддаются лечению. Кроме того, скрининг определяет рак на любой стадии.
Комплексное исследование включает такие методы:
- Цитология шейки матки. Это основа скринингового теста. Исследуя мазок из цервикального канала, определяют наличие в нем атипичных клеток. Тип аномалии клеточных структур и их количество говорит о стадии предракового или онкологического процесса.
- Определение ВПЧ. В 95% случаев рак шейки матки развивается при заражении женщины вирусом папилломы человека. Именно поэтому выявление ВПЧ – важная часть диагностики онкологии.
- Расширенная кольпоскопия. Иногда скрининг шейки матки включает проведение кольпоскопии. Это метод визуального осмотра стенок цервикального канала при помощи эндоскопа.
Методы визуализации плода
В современных условиях ультразвуковое исследование является наиболее распространенным методом пренатальной визуализации плода. Ультразвуковая диагностика и уровня выполняется в сроки 18-22 нед гестации потому, что анатомические структуры плода до 18 нед визуализировать трудно. При подозрении на аномалии развития плода повторное УЗИ выполняется в 23-24 нед гестации для решения вопроса о прерывании беременности в случае подтверждения аномалий развития плода. Прицельное УЗИ II уровня проводится с целью дифференциации таких состояний:
1) расщепление губы;
2) полидактилия;
3) согнуты ступни;
4) дефекты нервной трубки;
5) аномалии брюшной стенки;
6) аномалии почек;
7) определение пола плода.
Обычно удается также выявить аномалии сердца и головного мозга, но не всегда есть достаточно данных для подтверждения диагноза. Трудными для диагностики является атрезия пищевода и трахеоезофагальная фистула, когда единственными признаками этого дефекта могут быть маленький или такой, который не визуализируется желудок и многоводие.
Эхокардиография плода используется для подтверждения данных ультразвуковой диагностики по возможностям пороков сердца, а также при наличии родственников I степени родства с пороками сердца; при хромосомных аномалиях и выявленных пороках развития плода; при генетических дефектах, которые могут сопровождаться аномалиями развития сердца, у пациенток с инсулинозависимым сахарным диабетом и при употреблении матерью медикаментов, ассоциированных с риском пороков сердца у плода. Ультразвуковая допплерометрия кровотока характеризует кровоток в камерах сердца плода и крупных сосудах.
Новейшими методами визуализации плода является магнитно-резонансная томография (МРТ) и трехмерная ультрасонография. Более точно визуализировать мозг и другие объемные структуры плода и раньше определить гипоксическое поражение плода, чем ультразвуковое исследование, позволяет МРТ. С целью пренатальной диагностики используют также биопсию тканей плода под ультразвуковым контролем.
Заболевания ЖКТ, проявляющиеся рвотой желчью
- Острые отравления, инфекционные заболевания (например, гепатит, сальмонеллез и пр.), острый гастрит.
- Заболевания желчного пузыря — холецистит, в том числе — калькулезный (с образованием камней), глистные поражения желчного пузыря (описторхоз).
- Заболевания печени.
- Заболевания поджелудочной железы — панкреатит.
- Заболевания и ситуации, когда нарушена нормальная проходимость желудочно-кишечного тракта:
- сужение желудка, чаще всего его выходного отдела (привратника), что возможно при язве желудка, опухолях, после оперативных вмешательств,
- закупорка желчных путей (холестаз) камнем, опухолями, спайками,
- непроходимость кишечника, причем рвота желчью может возникать при нарушении пассажа и в тонком, и в толстом кишечнике.
Спорный скрининг
Сегодня нередко мужчинам приписывают необходимость проходить скрининг на рак простаты — его пытаются определить сдачей анализа на ПСА. При этом исследования по данному вопросу показывают, что эффективность данного метода на самом деле небольшая и к снижению смертности от этого рака не приводит. Гипердиагностика по данному вопросу не всегда на пользу. Потому что выявление тех опухолей, которые, весьма вероятно, не стали бы проявляться клинически, не стоит потенциального риска напрасной биопсии (когда обследуют доброкачественное образование) и последующего сложного лечения — операций, лучевой терапии и т.д.
Поэтому большинство специалистов сегодня рекомендует обсудить с мужчинами в возрасте от 50 до 70 лет возможность скрининга, учитывая все индивидуальные риски. Если о рисках вам не было рассказано и решение о такой диагностике было принято не вами, то назвать это скринингом на рак не совсем правильно.
Пренатальный скрининг в I триместре
В первом триместре беременности обычно происходит первый пренатальный визит, и проводятся необходимые лабораторные исследования. Первый триместр является оптимальным временем для скрининга, так как много тестов в этот период является более чувствительными и есть время для установления диагноза, а также, в случае необходимости, прерывание беременности.
Скрининговое ультразвуковое исследование в I триместре выполняется с целью визуализации и документации следующих признаков:
- Локализация гестационного мешка;
- Идентификация эмбриона;
- Измерение теменно-копчикового размера и определение гестационного возраста;
- Идентификация сердечной активности эмбриона;
- Количество плодов;
- Состояние матки, шейки матки и придатков матки;
- Наличие, размер и форма желточного мешка.
Если диаметр гестационного мешка превышает 25 мм при трансабдоминальном УЗИ, жизнеспособный эмбрион может быть идентифицирован, сердечная деятельность визуализируется с 7-8 недели гестационного возраста. При трансвагинальном УЗИ средний диаметр плодного яйца, достаточный для идентификации, равна 18 мм, сердечная деятельность визуализируется с 6,5-й недель гестационного возраста. Нормальный гестационный мешок обычно визуализируется при УЗИ при уровне 0-ХГЧ более 1000 мМЕ / мл.
При идентификации сердечной активности эмбриона в I триместре частота самопроизвольных выкидышей обычно не превышает 5% и может несколько увеличиваться в возрасте матери> 35 лет и при наличии в анамнезе самопроизвольных выкидышей. Определение гестационного возраста эмбриона в I триместре проводят по величине теменно-копчикового диаметра (наиболее точный показатель, ошибка в I триместре не превышает 3-5 дней).
Симптом пустого плодного яйца — прекращение развития фертилизованой яйцеклетки. Отсутствие фетального полюса в гестационном мешке диаметром > 3 см свидетельствует о синдроме пустого плодного яйца.
Ультразвуковое исследование толщины задней шейной складки плода (утолщение складки) является скрининговым тестом диагностики анеуплоидии, в частности синдрома Дауна у плода (чувствительность 60-90%). Для повышения точности диагностики дополнительно используют сывороточные тесты: уровень / 3-ХГЧ и плазменного протеина А, ассоциированного с беременностью (РАРР), чувствительность сывороточных тестов составляет 60%, частота ложноположительных результатов — 5%, а в комбинации с ультразвуковым скринингом чувствительность возрастает до 80%.
Пренатальная диагностика
Пациентки, которые являются носителями генетических заболеваний или имеют высокий риск анеуплоидии в связи с возрастом, или при наличии положительных скрининговых тестов подлежат осуществлению пренатальной диагностики как следующего шага обследования. Пренатальная диагностика состоит в получении клеток плода для определения его кариотипа и ДНК-тестов. Сегодня существует несколько методов пренатальной диагностики:
- амниоцентез;
- биопсия ворсин хориона;
- транскутанного кордоцентез;
- биопсия тканей плода под ультразвуковым контролем.
Амниоцентез
Амниоцентез выполняется после 15 нед гестации (оптимально в 16-18 нед), когда происходит слияние амниона и хориона, с целью исследования кариотипа плода, в том числе, когда возраст матери более 35 лет. Методика амниоцентеза заключается в трансабдоминальном введении иглы через матку в амниотическую полость (под ультразвуковым контролем) и взятии некоторого количества амниотической жидкости. Амниотическая жидкость содержит клетки плода, которые культивируют с целью определения кариотипа плода, проведение ДНК-тестов, исследования уровня АФП для скрининга пороков нервной трубки.
Культивация клеток длится 5-7 дней, тогда как новый метод молекулярной диагностики — РИ8Н-анализ — может выявить анеуплоидию в течение 24-48 час. Риск осложнений, связанных с амниоцентезом, составляет 1: 200-1: 300 и включает риск преждевременного разрыва плодных оболочек, преждевременных родов и, редко, травмы плода. Риск, связанный с амниоцентезом, оправдано не только тогда, когда риск заболевания плода превышает 1 200 (например, в случае синдрома Дауна, когда возраст матери составляет более 35 лет), но и в связи с разницей в последствиях (выкидыш или рождение ребенка с синдромом Дауна и т.д.).
Биопсия ворсин хориона
Биопсия ворсин хориона используется для определения кариотипа плода в более ранние сроки, чем амниоцентез (в промежутке между 10 и 12-й неделями беременности). Методика биопсии ворсин хориона заключается в трансабдоминальном или трансвагинальном введении катетера в полость матки и аспирации небольшого количества ворсин хориона из плаценты.
Риск осложнений биопсии хориона может быть больше, чем при амниоцентезе (1: 100). В связи с возможностью получения большего количества клеток, чем при амниоцентезе, диагноз можно получить быстрее. Недостатком этой методики является то, что исследуются клетки плаценты, а не плода, поэтому в редких случаях мозаицизма плаценты возможен ошибочный диагноз. Осложнения биопсии ворсин хориона включают преждевременные роды, преждевременный разрыв плодных оболочек, рождение нежизнеспособного плода, травмы плода.
При выполнении биопсии ворсин хориона в сроке менее 9-10 нед риск аномалий конечностей плода (вторично — вследствие прекращения кровоснабжения, вазоконстрикции, травмы сосудов). Недостатком также является невозможность определения АФП в амниотической жидкости.
Транскутанный кордоцентез
Методика транскутанного кордоцентеза заключается в трансабдоминальном введении иглы в матку через пупочный канатик во внутрипеченочную вену плода под ультразвуковым контролем. Перед процедурой выполняют медикаментозную иммобилизацию плода, определяют его гематокрит (особенно в случае резус-иммунизации, других возможных причин анемии или водянки плода). Транскутанный кордоцентез используется для быстрого анализа кариотипа плода (через 48 ч), так как количество полученных клеток является значительным, следовательно, они не нуждаются в культивации перед исследованием. Кроме того, можно провести анализ по внутриутробным инфекциям, гематологическим заболеваниям, иммунному статусу и кислотно-щелочному состоянию. Путем кордоцентеза можно проводить гемотрансфузии плода (в случае гемолитической болезни и анемии плода), выполнять лечение аритмии плода.
Недостатком транскутанного кордоцентеза опасность травмы, кровотечения и гибели плода (3-5 / 100 случаев).
Подбор дизайна для одной возрастной группы и для разных возрастов
Когда помещение делят между собой две хозяйки-ровесницы, нет необходимости в строгом зонировании помещения. Комната для двух девочек одного возраста может быть оформлена по следующему образцу:
Оформление в единой цветовой гамме. Выбор дизайна, который понравится обеим дочерям, может затянуться на длительное время. Но найденное решение примирит сестер и позволит сделать интерьер комнаты завершенным. Чтобы облегчить выбор, достаточно сузить круг до однотонных поверхностей.
Подвесное креслоИсточник remont-f.ru
Если в комнате будут жить сестры разного возраста, то рекомендуется четко зонировать помещение. Разделение пространства не только с помощью перегородок, но и по средствам цвета — это возможность создать неповторимый интерьер. Советы дизайнеров, которые пригодятся при оформлении детской:
Рекомендуется выделить рабочую зону в ближайшем от окна месте. Там расположить парту с регулируемой высотой и письменный стол с ящиками и полочками. Благодаря изменяющимся параметрам «трансфомера», его можно использовать длительное время, подстраивая характеристики под рост ребенка. По отзывам родителей, парта подходит для детей от 6 до 13 лет. Старшая дочь может использовать многофункциональный письменный стол на протяжении всего срока обучения в старшей школе и университете.
Оформление потолкаИсточник remvizor.ru
Мебель с фиолетовыми вставкамиИсточник remontkvartiri.su
- Большая двуспальная кровать или две отдельные постели. Первый вариант популярен при дизайне малогабаритной детской. Пока обе девочки маленькие, они могут делить между собой одну большую кровать.
- Разделение зоны отдыха и уголка для чтения. Размещение в одной комнате книжного шкафа и игрушек возможно только при установке четкой перегородки. Ширму или стену ПВХ можно заменить диваном или кроватью с высокой спинкой. В таком случае сестры не будут мешать друг другу отдыхать или заниматься.
Комната для двух сестер разного возрастаИсточник yandex.ru
Стильное пространствоИсточник priamurka.ru/
Комната со станком для занятийИсточник design-homes.ru
Бирюзовые элементы Источник priamurka.ru/
Исследование мочи по НЕЧИПОРЕНКО
Исследование мочи по Нечипоренко назначено Вашим врачом.
Цель исследования — объективно оценить Ваше состояние.
Для получения достоверных результатов Вам необходимо подготовить себя к этому исследованию: воздержаться от физических нагрузок, приема алкоголя, лечь спать накануне в обычное для Вас время. Вы должны собрать первую утреннюю порцию мочи. Емкость для сбора мочи Вы можете получить в процедурном кабинете лаборатории заранее до сбора мочи.
Перед сбором мочи Вам необходимо провести тщательный туалет наружных половых органов, промыв их под душем с мылом, чтобы в мочу не попали выделения из них. Предварительно напишите на этикетке емкости для мочи Ваши данные: Ф.И.О., дату рождения, дату и время сбора материала, запись должна быть сделана разборчивым почерком.
После этой подготовки Вы идете в туалет и собираете среднюю порцию мочи в емкость (100-150 мл). Завинчиваете емкость крышкой и доставляете мочу в процедурный кабинет лаборатории, где сдаете ее медицинской сестрой.
Он показывает качество функционирования выделительной системы. Перед сбором мочи необходимо провести туалет половых органов.Для анализа используют среднюю порцию мочи. Мочу необходимо доставить в лабораторию не позднее 2 часов после сбора.
ЦВЕТот соломенного до желтого.Насыщенность жёлтого цвета мочи зависит от концентрации растворённых в ней веществ. Окраска меняется при приёме лекарственных препаратов (салицилаты и др.) или употреблении некоторых пищевых продуктов (свекла, черника). Мутная моча – означает наличие в ней примесей солей (фосфатов, уратов, оксалатов кальция), бактерий, эритроцитов, что может говорить о воспалительных заболеваниях почек.
КИСЛОТНОСТЬмочи (РН) зависит от характера питания.Если вы любите мясную пищу, то при анализе мочи будет наблюдаться кислая реакция мочи, если вы вегетарианка или придерживаетесь молочной диеты, то реакция мочи будет щелочная. При смешенном питании образуются главным образом кислые продукты обмена, поэтому считается, что в норме реакция мочи кислая. Щёлочная реакция мочи характерна для хронической инфекции мочевыводящих путей, а также отмечается при поносах, рвоте. Кислотность мочи увеличивается при лихорадочных состояниях, сахарном диабете, туберкулёзе почек или мочевого пузыря, почечной недостаточности.
УДЕЛЬНЫЙ ВЕС(удельная плотность) характеризует фильтрующую функцию почек и зависит от количества выделенных органических соединений (мочевины, мочевой кислоты, солей), хлора, натрия, калия, а также от количества выделяемой мочи.В норме удельный вес составляет 1010-1030. Изменения удельного веса мочи в сторону снижения могут свидетельствовать о хронической почечной недостаточности. Повышение удельного веса говорит о воспалительных заболеваниях почек (гломерулонефрите), возможном сахарном диабете, больших потерях жидкости или малом ее употреблении.
БЕЛОКв моче здорового человека отсутствует. Его появление обычно говорит о заболевании почек, обострение хронических заболеваний почек.
ГЛЮКОЗАв норме в общем анализе мочи отсутствует.
ЛЕЙКОЦИТЫв норме могут присутствовать в моче в количестве 0-5 в поле зрения. Увеличение числа лейкоцитов в моче (лейкоцитурия, пиурия) в сочетании с бактериурией и обязательно при наличии каких-либо симптомов (например, учащенное болезненное мочеиспускание, или повышение температуры тела, или болевые ощущения в поясничной области) свидетельствует о воспалении инфекционной природы в почках или мочевыводящих путях.
ЭРИТРОЦИТЫ и БАКТЕРИИ. Эритроциты в норме могут присутствовать в моче в количестве 0-3 в поле зрения. Бактерии в норме в общем анализе мочи отсутствуют. Наличие бактерий – признак хронических или острых заболеваний почек, мочевыводящих путей. Особенно опасное явление – бессимптомная бактериурия, то есть наличие изменений в анализах при отсутствии жалоб пациентки. Опасно оно из-за того, что может протекать сколь угодно длительно без соответствующего лечения и наблюдения, во время беременности при этом развиваются воспалительные заболевания мочевыделительной системы, что оказывает отрицательное влияние на течение беременности и на состояние плода.
ЦИЛИНДРЫ внорме в общем анализе мочи отсутствуют. Цилиндрурия является симптомом поражения почек, поэтому она всегда сопровождается присутствием белка и почечного эпителия в моче.
Опубликовано: webapteka.by 15 декабря 2010
В каких случаях необходим скрининг во втором триместре беременности
- если оба родителя достигли возраста 35+;
- когда в роду имеются наследственные генетические заболевания;
- если беременная переболела на ранних сроках вирусной инфекцией: некоторые казалось бы «безобидные» заболевания могут негативно отразиться на здоровье будущего ребенка;
- если в анамнезе женщины уже встречались случаи, связанные с замершей беременностью, выкидышем, мертворождениями;
- когда беременная применяла препараты, обладающие тератогенным действием;
- если у будущих матери или отца существует алкогольная или наркотическая зависимость;
- если у детей, рожденных от прежних беременностей, были обнаружены хромосомные аномалии;
- если у будущей матери обнаружены хронические или аутоиммунные заболевания, способные повлиять на развитие будущего ребенка и его рост;
- в случаях выявления злокачественных новообразований у женщины, которая находится уже на третьем месяце или более позднем сроке беременности;
- когда кто-то из родителей будущего ребенка незадолго до срока зачатия или в этот период трудился на производстве, где присутствует радиационное облучение или имеющем статус «вредного».
Второй скрининг при беременности позволяет увидеть те проблемы и патологии, которые нельзя было обнаружить на ранних сроках. Кроме того, скрининг помогает определить предполагаемые риски опасных состояний, которые могут развиться в недалеком будущем, а также увидеть отклонения в функционировании основных систем организма плода
И хотя исследования, проводимые на первом скрининге, врачи считают более информативными, важность второго скрининга нельзя недооценивать. Ведь многие беременные с нетерпением ждут подтверждения или опровержения информации, полученной ранее
Как скрининги помогают снизить риск смерти из-за рака молочной железы?
На этот вопрос ответили ученые из Лондонского университета королевы Марии и Центральной больницы г. Фалун (Швеция). Они проанализировали данные более 52000 женщин в возрасте 40-69 лет, которые регулярно обследовались в период с 1977 по 2015 гг. (до постановки диагноза РМЖ).
Исследователи обнаружили, что у женщин, которые проходили скрининги, следуя действующим рекомендациям, риск смерти в течение 10 лет после выявления заболевания был ниже на 60%, а через 20 лет — на 47% (относительный риск — 0,40 и 0,53 соответственно). Все участницы получали своевременное лечение в соответствии с утвержденными на тот момент гайдлайнами.
Нужен ли скрининг, если нет симптомов
Рак молочной железы коварен тем, что на ранних стадиях он никак не проявляет себя. Определенные симптомы могут возникать лишь на второй стадии, а на третьей стадии они становятся выраженными. Если начать лечить рак на первой стадии, то показатель пятилетней выживаемости составит до 97%, на второй стадии он снижается до 75%, на третьей – до 50% и на четвертой – до 10%. То есть, чем раньше выявлена болезнь, тем более благоприятным будет прогноз.
Согласно исследованиям, показатель смертности от рака молочной железы ниже на 30-50% в тех группах, где женщины регулярно проходят скрининг и владеют техникой самообследования молочных желез. Этот факт еще раз подтверждает пользу скрининга рака молочной железы.
Объем обследования зависит не от симптомов, а от возраста женщины. До 40 лет достаточно проводить самообследование молочных желез раз в месяц. В возрасте от 40 до 50 лет кроме самообследования необходимо раз в год консультироваться с врачом, а после 50-летнего возраста 1-2 раза в год проходить скрининговую маммографию.
Что делать, если результаты скрининга оказались положительными
Если во время обследования выявляются отклонения в одном или нескольких анализах, то дальнейшая тактика может отличаться. При отсутствии сомнений в диагнозе, пациенту сразу же назначается лечение, при необходимости он госпитализируется в стационар. Если же полученных данных недостаточно для постановки диагноза, то врач составляет план дообследования. Например, при выявлении объемных новообразований может потребоваться биопсия печени или другое специфическое исследование.
Лечение заболеваний печени может проводиться как оперативными, так и консервативными методами. Если с помощью скрининга удалось выявить начальные формы рака, то всегда стараются применять хирургические методики, которые направлены на удаление части органа. Иногда операции сочетают с химио- или лучевой терапией.
При выявлении других болезней печени назначается соответствующая терапия, результаты которой оцениваются во время контрольных обследований.
Запись на консультацию круглосуточно
+7 (495) 151-14-53+7 (861) 238-70-54+7 (812) 604-77-928 800 100 14 98
Когда нужно проводить первый скрининговый тест?
Забор материала на цитологию неизбежно приводит к незначительным травмам слизистой оболочки шейки. В связи с этим, тест не проводится молодым девушкам, которые не ведут половую жизнь. Первый скрининг рекомендован через три года после потери девственности. Если состоялось заражение ВПЧ, спустя это время появляются первые признаки клеточных изменений в тканях шейки.
В разных странах рекомендованный возраст первого скрининга отличается:
- исследование шейки в США рекомендовано после 18 лет;
- в большинстве стран Европы – после 21 года;
- в Голландии и Финляндии тест проводят только после 30 лет.
Это объясняется также низкой вероятностью развития рака шейки матки у женщин, моложе 25 лет.