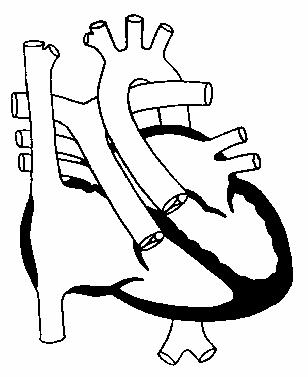
Гиперэхогенный фокус в левом желудочке сердца плода
Содержание:
- Что такое гиперэхогенность в сердце плода
- Все виды диагностики важны – от осмотра до УЗИ
- Дефект межпредсердной перегородки
- Патогенез (что происходит?) во время Опухолей надпочечников:
- На пятом этапе работы ГЭФ запустит в России Программу малых грантов
- 2Порок развития или признак хромосомных нарушений
- Диагностика
- Дилатация корня аорты и синусов Вальсальвы
- Причины ВПС
- Когда гиперфокус – норма?
- Какие симптомы у врожденного порока сердца?
- Гепатоцеллюлярная аденома (ГЦА)
Что такое гиперэхогенность в сердце плода
Гиперэхогенный фокус сердца плода подразумевает наличие уплотнения в структуре сердечной мышцы. В результате ультразвуковые волны в большей степени отражаются от участка миокарда и дают светлое пятно на экране. Включение, как правило, имеет диаметр 2—3 миллиметра. Чаще всего это обнаруживается у женщин старше 35 лет на 18—22-й неделе беременности. Наиболее характерен феномен для представительниц азиатских стран. На европейском континенте подобное явление встречается намного реже (в 7—10 % случаев). Обычно уплотнение исчезает к концу третьего триместра, однако нередко остается вплоть до родов.
Чаще всего находят гиперэхогенное включение в левом желудочке сердца плода, тем не менее оно может визуализироваться и в других частях органа. Более опасным считается присутствие повышенной эхогенности в правых отделах.
Патологическим данное явление может считаться лишь в случаях, когда оно сопутствует другим признакам врожденных заболеваний
Также важно помнить, что это всего лишь диагностический признак, который не является самостоятельной патологией и не несет каких-либо негативных последствий в будущем
Источником гиперэхогенного включения сердца плода может быть отложение солей кальция в сосочковых мышцах левого желудочка. В указанные сроки происходят значительная активация минерального обмена и интенсивное формирование костной системы. Со временем соль всасывается в кровь и уплотнение исчезает.
В некоторых случаях подобный симптом дает наличие добавочной хорды. Это соединительнотканная нить, которая проходит от клапанов сердца к папиллярным (сосочковым) мышцам. Чаще всего каждой мышце соответствует одна нить, однако в данном случае их образуется несколько.
При прохождении крови через хорды будут возникать завихрения, которые могут образовывать сердечные шумы, выслушиваемые при аускультации. Об этом следует помнить, потому что в дальнейшем из-за присутствия данного феномена педиатр может поставить неправильный диагноз. Несмотря на то что это явление рассматривается как аномалия сердца, такой вариант развития принимается за норму.
Обнаружение дополнительной хорды не требует дальнейшего исследования и лечения. Как правило, они срастаются еще до рождения или в первые годы жизни.
Раньше считалось, что ГЭФ ЛЖ является четким признаком синдрома Дауна или других хромосомных заболеваний. Но в последние годы появилось много научных работ, благодаря которым теперь известно, что это справедливо лишь при наличии дополнительных симптомов. Обнаружение только одного этого признака не может быть поводом для беспокойства, дальнейшие обследования не требуются.
В большинстве случаев при обнаружении гиперэхогенного включения показано проведение дополнительного исследования. При этом могут назначить:
- повторное УЗИ для уточнения диагноза;
- эхокардиоскопию (проводят только до 25-й недели);
- биохимический анализ крови;
- кариотипирование.
Достаточно редко применяют инвазивные диагностические процедуры:
- амниоцентез (взятие пробы околоплодных вод через брюшную стенку);
- плацентоцентез (биопсия клеток плаценты);
- фетоскопию (исследование плода при помощи видеозонда).
В первую очередь, конечно же, следует исключить генетические причины гиперэхогенного включения. Для этого врач-диагност проводит поиск других малых маркеров хромосомных патологий. К ним относятся врожденные пороки сердца, утолщение шейной складки, нарушения развития желудочно-кишечного тракта, костной системы. Обычно они выявляются в ходе ультразвукового исследования. При их обнаружении необходима консультация у специалиста-генетика.
Если никаких дополнительных признаков не обнаружено, плод можно считать вполне здоровым. Тем не менее в первые месяцы после рождения рекомендуется провести контрольную эхокардиографию. Данная процедура позволит окончательно убедиться в отсутствии каких-либо патологических изменений.
Таким образом, обнаруживаемое при УЗИ гиперэхогенное включение не является самостоятельным диагнозом. По системе оценки маркеров хромосомных аномалий ему начисляют лишь один балл, что не может быть поводом для беспокойства.
Чаще всего ГЭФ возникает вследствие физиологических процессов или доброкачественных аномалий развития сердца (появление ложной хорды). При этом, если не обнаружено других анатомических или функциональных отклонений, не требуется никаких дальнейших обследований и лечения. Достаточно будет контроля при проведении планового УЗИ в третьем триместре беременности.
Все виды диагностики важны – от осмотра до УЗИ
Диагностический комплекс исследования патологии надпочечников должен включать: клинический осмотр, лабораторные (клинические, биохимические, гормональные), инструментальные и патоморфологические методы обследования. Клинический осмотр и опрос пациентов проводят для выявления признаков, характерных для различных симптомокомплексов надпочечниковой патологии. В лабораторной диагностике для выявления патологии надпочечников наиболее часто определяют уровни адренокортикотропного гормона, кортизола, альдостерона, дегидроэпиандростерона-сульфата (ДЭА-сульфата), активность ренина и ангиотензина плазмы крови, суточную экскрецию адреналина, норадреналина и ванилилминдальной кислоты в моче.
С целью топической диагностики используют с цветным доплеровским сканированием, компьютерную рентгеновскую томографию (), (), в сложных случаях с целью дифференциальной диагностики – ангиографию или селективную флебографию с раздельным забором крови. В ряде случаев для верификации морфологической структуры образований надпочечников проводится аспирационная пункция тонкой иглой под контролем УЗИ или КТ с цитологическим исследованием.
УЗИ почек
Стоимость: 2 700 руб.
Подробнее
Дефект межпредсердной перегородки
Различают вторичный и первичный дефект.
Вторичный локализуется в области овального окна и проявляется дефицитом
структуры в отличии от открытого овального окна. Этот вариант порока
составляет 70% от всех типов ДМПП (рис.74).
Рис.74.
Вторичный дефект
межпредсердной
перегородки (схема).
Первичный дефект локализуется в области центрального фиброзного
тела, составляет 20% от всех типов ДМПП и часто сочетается с полной
или частичной формой открытого атриовентрикулярного канала. Дефект
венозного синуса составляет 2-4% от всех ДМПП и локализуется в области
соединения межпредсердной перегородки с верхней полой веной, часто
сочетается с аномалиями легочных вен.
Одномерная ЭхоКГ:
- Дилатация правого желудочка.
- Объемная перегрузка правого желудочка.
- Увеличение экскурсии передней створки трикуспидального
клапана. - Парадоксальное (А, В типы) движение межжелудочковой
перегородки. - Преждевременное открытие клапана легочной артерии.
- Диастолическое трепетание передней створки трикуспидального
клапана
Двухмерная ЭхоКГ:
Прямая визуализация дефекта (рис.75).
- Вторичный дефект проявляется дефицитом структуры
в области овального окна.
Рис.75.
Вторичный дефект
межпредсердной
перегородки.
- Первичный ДМПП — визуализируется в
проекции 4-х камер с верхушки или из субкостального доступа в области
центрального фиброзного тела-место соединения межпредсердной перегородки
с межжелудочковой перегородкой (рис.76).
Рис.76.
Первичный дефект
межпредсердной
перегородки.
- Дефект венозного синуса — прямая
визуализация дефекта из субкостального доступа проксимально впадению
верхней полой вены в правое предсердие.
Дифференциальный диагноз:
- При допплер-ЭхоКГ необходимо дифференцировать нормальный
поток в верхней полой вене от шунтового через дефект. - Открытый атриовентрикулярный канал.
- Аномалия Эбштейна (при этом пороке дефект межпредсердной
перегородки или открытое овальное окно определяются в 85% случаев). - Триада Фалло.
Патогенез (что происходит?) во время Опухолей надпочечников:
Надпочечники вырабатывают гормоны, регулирующие обмен веществ, артериальное давление, а также женские и мужские половые гормоны. Так что основные проявления опухоли надпочечника связаны с действием того гормона, который она вырабатывает в избыточном количестве.
Различают первичныеи метастатические опухоли надпочечников
Первичные опухоли надпочечниковотносятся к одному из важных и трудных в диагностическом и лечебном плане разделов клинической онкологии. Эти заболевания объединяют группу различных вариантов опухолей, в число которых входят и гормональноактивные опухоли надпочечников. Общепринято классифицировать опухоли надпочечников на доброкачественные и злокачественные
Это имеет важное практическое значение относительно прогноза заболевания, так как хирургическое удаление доброкачественной опухоли ведет к полному выздоровлению, тогда как прогноз при злокачественных новообразованиях сомнителен. При этом морфологические признаки злокачественности опухолей надпочечников дискутируются до настоящего времени
Если до недавнего времени считалось, что опухоли надпочечников являются редкой патологией и составляют не более 0,6% всех злокачественных опухолей, то в настоящее время благодаря широкому внедрению в повседневную клиническую практику таких неинвазивных, но весьма информативных методов диагностики, как УЗИ, КТ, МРТ, резко возросло число обнаруживаемых новообразований в забрюшинном пространстве. Часть таких образований локализуется в надпочечнике и в большинстве случаев является опухолями, исходящими либо из коркового, либо мозгового его слоев.
Надпочечники имеют сложное гистологическое строение и состоят из двух отличающихся друг от друга в эмбриологическом и морфологическом отношении слоев – коркового и мозгового.
В отечественной и зарубежной литературе существует большое количество различных классификаций опухолей надпочечников. В настоящее время в основном используется классификация, основанная на гистогенетическом принципе:
-
Эпителиальные опухоли коры надпочечников:
- аденома,
- карцинома.
-
Мезенхимальные опухоли:
- миелолипома,
- липома,
- фиброма,
- ангиома.
-
Опухоли мозгового слоя надпочечников:
- феохромоцитома,
- нейробластома,
- ганглиома,
- симпатогониома.
Одной из наиболее удобных клинико–морфологических классификаций является классификация, предложенная Micali F. et al. (1985).
Злокачественные опухоли надпочечников нуждаются в клинической классификации по стадиям. Одними из первых пытались решить эту задачу Macfarlan D.A. в 1958 году, а затем Sullivan M. в 1978, который модифицировал классификацию Macfarlan D.A. по системе TNM:
- T1 – относительно малые размеры опухоли – до 5 см.
- T2 – относительно большие размеры опухоли – более 5 см.
- T3 – любой размер опухоли с местной инвазией в окружающие ткани.
- T4 – любой размер опухоли с прорастанием в окружающие органы, печень, почки, поджелудочную железу, нижнюю полую вену.
- N0 – регионарные лимфатические узлы не увеличены.
- N1 – имеются метастазы в парааортальные и паракавальные лимфатические узлы.
- N2 – имеется поражение лимфатических узлов других локализаций.
- M0 – нет отдаленных метастазов.
- M1 – есть отдаленные метастазы.
- Стадия I – T1N0M0
- Стадия II – T2N0M0
- Стадия III – T1N1M0, T2N1M0, T3N0M0
- Стадия IV – T4N2M0, T4N2M1.
Однако данная классификация нуждается в совершенствовании и не находит широкого применения в лечебной практике. Чаще всего используется классификация, предложенная О.В. Николаевым (1963), согласно которой опухоли делятся на следующие виды: кортикостерома, андростерома, кортикоандростерома, альдостерома, кортикоэстрома и комбинированные опухоли. Каждая из них может быть доброкачественной или злокачественной.
На пятом этапе работы ГЭФ запустит в России Программу малых грантов
Запущенная в 1992 году Программа малых грантов ГЭФ предусматривает поддержку мероприятий, направленных на уменьшение влияния на климат, сохранение биологического разнообразия, охрану международных вод, уменьшение вреда от стойких органических загрязнителей, предотвращение деградации земель и создание благоприятных условий обитания, реализуемых негосударственными и общественными организациями в развивающихся странах.

Финансируемая Фондом программа включена в состав мероприятий ПРООН в рамках сотрудничества с ГЭФ и реализуется через Управление по обслуживанию проектов ООН (УОП ООН).
На сегодняшний день в рамках Программы малых грантов поддержку получили более 13 000 проектов по всем основным направлениям деятельности ГЭФ, реализованных общественными организациями в 122 странах. Максимальная сумма гранта, выделяемого на проект, составляет 50 000 долларов США, средняя — 25 000 долларов. Гранты направляются непосредственно общественным и негосударственным организациям.
На пятом этапе работы ГЭФ Программа малых грантов начнет работу и в России, открывая перед общественными организациями возможность реализовать свои проекты по охране окружающей среды. Потенциал Программы можно оценить, ознакомившись с примерами проектов, успешно реализованных в Румынии.
Думбравиоара — деревня аистов
В румынской деревне Думбравиоара (близ г. Таргу-Муреш) находится 14 гнезд белых аистов, которые Milvus Group Association, реализовавшей проект в рамках Программы малых грантов, удалось превратить в источник дохода для местных жителей. Был создан первый в Румынии музей аистов, где представлен деревянный макет деревни с указанием местонахождения гнезд аистов. Веб-камера, установленная на одном из гнезд (на фото), позволяет посетителям музея в режиме реального времени наблюдать за аистами в естественной среде обитания. После подключения к сети Интернет возможность понаблюдать за жизнью аистов появилась у всех. Фестиваль аистов, учрежденный в 2005 г. в рамках реализации проекта, стал уже традиционным. Milvus Group Association совместно с компанией электрических сетей разработала новаторское решение, позволяющее изолировать гнезда аистов от высоковольтных линий.

В настоящее время Milvus занимается реализацией еще одного проекта в рамках Программы малых грантов ГЭФ. Его цель — разработка плана рационального использования охраняемых зон рыбоводных прудов Лернут (Lernut) и Сипау (Cipau), а также контроль эффективности мер по сохранению биологического разнообразия и устранение конфликтов, вызванных применением нерациональных методов землепользования в охраняемых зонах.
Спасение черноморских дельфинов
Занимающие вершину пищевой пирамиды в экосистеме Черного моря дельфины подвержены воздействию целого ряда угроз из-за деятельности человека. Компания Mare Nostrum внесла значительный вклад в предотвращение гибели дельфинов из-за попадания в рыбацкие сети, распространив среди рыболовных компаний акустические отпугиватели, а также начав работу с рыболовными сообществами, направленную на предотвращение случайного отлова.
Охрана летучих мышей Восточных Карпат и Апусени

Румынская ассоциация по охране летучих мышей (РАОЛМ) реализовала проект, целью которого является повышение внимания к охране подземных экосистем пяти основных известняковых пещер в Восточных Карпатах и Апусени
В рамках проекта проведено изучение обстановки в пещерах, определение этих пещер как мест, имеющих общественную важность (Natura, 2000 г.), и привлечение добровольцев из числа местного населения к охране летучих мышей и участию в образовательных походах, что в конечном счете должно повысить интерес общественности к сохранению популяции этих животных. Для борьбы с суевериями и страхом перед летучими мышами, помимо образовательных походов, было организовано празднование «Ночи летучей мыши», ставшее впоследствии традиционным
В настоящее время РАОЛМ занимается реализацией нового проекта, нацеленного на охрану летучих мышей в антропогенной среде. В его рамках предусмотрено снижение влияния человека на жизнь летучих мышей, изучение влияния наружного освещения на процесс их охоты, определение влияния сельскохозяйственных работ на состояние мест их обитания, а также повышение осведомленности общественности по вопросам сохранения биологического разнообразия, энергоэффективности и рационального землепользования.
2Порок развития или признак хромосомных нарушений
Избыточное пропитывание солями кальция
Да-да, именно такую реакцию у родителей может вызвать подобное заключение врача УЗИ-диагностики. На самом деле, ни то, ни другое не является истиной. Гиперэхогенный фокус в левом желудочке сердца плода — это не порок развития и не аномалия. Многие родители пугаются того, что подобного рода находка в сердце ребенка является признаком тяжелой хромосомной патологии, к примеру, наличия синдрома Дауна.
Почему же возникает такой фокус повышенной плотности во внутриутробном периоде? Есть несколько возможных причин.
- Избыточное пропитывание солями кальция (кальциноз) определенного участка сердечной мышцы. Чаще всего такие изменения локализуются в области сосочковых (папиллярных) мышц. Второй триместр беременности, во время которого чаще всего обнаруживаются подобные изменения, характеризуется активной минерализацией опорно-двигательного аппарата ребенка.
- Наличие дополнительной или ложной хорды в желудочке сердца ребенка. Такая ложная или дополнительная хорда не несет функциональной нагрузки, и не является патологией, а относится к малым аномалиям развития сердца (МАРС). Подобное явление — частая находка во время ультразвукового исследования. Сами хорды во внутриутробном периоде могут провоцировать отложение солей кальция, а также усиливать яркость гиперэхогенного фокуса.
- Один из признаков, указывающих на хромосомную патологию. Напомним еще раз, что при отсутствии иных достоверных признаков хромосомных патологий, наличие уплотнения или гиперэхогенного фокуса в левом желудочке сердца плода не указывает на генетические нарушения.
Диагностика
При обнаружении на плановом УЗИ данной патологии назначаются следующие методы диагностики:
- УЗИ с объемной реконструкцией, то есть 3Д УЗИ, которое позволяет наиболее подробно рассмотреть строение сердечной мышцы;
- эхокардиоскопия сердца плода — изучение работы и строения сердца при помощи ультразвука;
- допплерография — разновидность УЗИ сердца;
кардиотокография сердца — регистрация частоты сердечных сокращений плода.
В некоторых случаях показаны дополнительные исследования:
- кордоцентез — прокол пуповины с дальнейшим забором крови для исследования;
- амниоцентез — прокол плодного пузыря с забором околоплодных вод.
Если все предыдущие методы диагностики не дали точного положительного диагноза, то беременная женщина направляется для обследования к генетику. В таком случае необходимо сдать кровь для более подробной диагностики изменений.
Дилатация корня аорты и синусов Вальсальвы
Является индикатором дисплазии соединительной ткани и наблюдается
при синдромах Марфана, Элерса-Данлоса и других наследственных соединительнотканных
заболеваниях. Однако,эти МАРС могут наблюдаться в изолированном виде
без внешних проявлений заболевания (идиопатическая дилатация корня
аорты). При выявлении дилатированного корня аорты (90 и более процентиль
кривой распределения) необходимо исключить постстенотическую дилатацию,
аортоартериит, артериальную гипертензию и другие заболевания. Дети
с широкой аортой без признаков соединительнотканного заболевания
часто имеют, как внешние малые аномалии развития (аналогичные первичному
пролапсу митрального клапана), так и другие МАРС (дополнительная трабекула
левого желудочка, дилатация ствола легочной артерии, эктазия митрального
кольца). При аускультации выслушивается акцент II тона, может определяться
шум волчка на сосудах шеи. Вероятно, идиопатическая дилатация
корня аорты является проявлением нарушения диспропорционального онтогенетического
развития у детей с наследственно обусловленной предрасположенностью
к слабости соединительной ткани.
Дилатация синусов Вальсальвы в отличии от аневризмы, не сопровождается
какими-либо клиническими и гемодинамическими нарушениями функции сердца.
Обычно наблюдается дилатация бескоронарного синуса в пределах 3 —
7 мм. Эти дети как и при идиопатической дилатации корня аорты имеют
внешние стигмы соединительнотканной дисплазии. Аускультативно могут
выслушиваться непостоянные щелчки. Прогностическая значимость дилатации
синусов в детском возрасте не определена. В ряде случаев, при динамическом
наблюдении за такими детьми в течении 2-3 лет, мы отмечали спонтанное
исчезновение расширения синусов Вальсальвы.
Причины ВПС
В качестве основных ведущих причины в формировании пороков, чаще всего, выступают структурные и количественные хромосомные аномалии, и мутации, т.е. первичные генетические факторы.
Также необходимо уделять внимание потенциально тератогенным факторам внешней среды: различные внутриутробные инфекции (вирусы краснухи, цитомегаловирус, коксаки, инфекционные заболевания у матери в первом триместре), лекарственные препараты (витамин А, противоэпилептические средства, сульфазалазин, триметоприм), постоянный контакт с токсичными веществами (краски, лаки). Кроме того, нужно помнить, что отрицательное влияние на внутриутробное развитие оказывают как материнские факторы: предшествующие данной беременности репродуктивные проблемы, наличие сахарного диабета, фенилкетонурии, алкоголизма, курение, возраст, но также, и факторы со стороны отца – возраст, употребление наркотических средств (кокаин, марихуана).. Ведущая роль принадлежит мультифакториальной теории развития врожденных пороков сердца (до 90%).
Ведущая роль принадлежит мультифакториальной теории развития врожденных пороков сердца (до 90%).
Виды врожденных пороков сердца
-
Дефект межпредсердной перегородки (ДМПП) или открытое овальное окно – диагностируется при выявлении одного либо нескольких отверстий в межпредсердной перегородке. Один из часто встречающихся врожденных пороков сердца. В зависимости от расположения дефекта, его величины, силы тока крови определяются более или менее выраженные клинические признаки. Часто ДМПП сочетается с другими аномалиями сердца и определяться при синдроме Дауна.
-
Дефект межжелудочковой перегородки (ДМЖП) – диагностируется при недоразвитии межжелудочковой перегородки на различных уровнях с формированием патологического сообщения между левым и правым желудочками. Может встречаться как изолированно, так и вместе с другими аномалиями развития. При малом дефекте – чаще нет выраженного отставания в физическом развитии. ДМЖП опасен тем, что может приводить к развитию легочной гипертензии, и потому, должен своевременно корректироваться оперативным путем.
-
Коартация аорты – сегментарное сужение просвета аорты с нарушением нормального кровотока из левого желудочка в большой круг кровообращения. Выявляется до 8% всех случаев ВПС, чаще у мальчиков, нередко сочетается с другими аномалиями.
-
Открытый артериальный проток – диагностируется при не заращении Баталлова протока, определяемого у новорожденных и зарастающего в последующем. В результате, происходит частичный сброс артериальной кровь из аорты в легочную артерию. При данном ВПС чаще не бывает тяжелых клинических проявлений, однако, патология требует хирургической коррекции, поскольку сопряжена с высоким риском внезапной сердечной смерти.
-
Атрезия легочной артерии – диагностируется недоразвитие (полное либо частичное) створок клапана легочной артерии с развитием обратного заброса крови из легочной артерии в полость правого желудочка. В последующем приводит к недостаточному кровоснабжению легких.
-
Стеноз клапана легочной артерии – аномалия, при которой диагностируют сужение отверстия клапана легочной артерии. В результате патологии, чаще всего, створок клапана, нарушается нормальный кровоток из правого желудочка в легочный ствол.
-
Тетрада Фалло – сложный сочетанный ВПС. Объединяет дефект межжелудочковой перегородки, стеноз легочной артерии, гипертрофию правого желудочка, декстрапозицию аорты. При данной патологии происходит смешение артериальной и венозной крови.
-
Транспозиция магистральных сосудов – также сложный ВПС. При данной патологии аорта отходит от правого желудочка и несет венозную кровь, а легочный ствол отходит от левого желудочка и несет артериальную кровь, соответственно. Парок протекает тяжело, сопряжен с высокой летальностью новорожденных.
-
Декстрокардия – аномалия внутриутробного развития, арактеризующаяся правосторонним размещением сердца. Зачастую, наблюдается «зеркальное» расположениее других непарных внутренних органов.
-
Аномалия Эбштейна – редко встречающийся врожденный порок сердца, диагностируется при изменении месторасположения створок трехстворчатого клапана. В норме — от предсердно-желудочкового фиброзного кольца, при аномалии — от стенок правого желудочка. Правый желудочек имеет меньшие размеры, а правое предсердие удлинено, вплоть до аномальных клапанов.
Когда гиперфокус – норма?
Происхождение гиперэхогенного фокуса в сердечной полости плода – до сих пор одна их самых сомнительных и таинственных загадок науки. Наиболее часто ее связывают с тем, что в отдельной части сердечной мышцы откладывается больше солей кальция. Считается, что это происходит именно тогда, когда у малютки начинаются интенсивные процессы минерализации костей. Это частично объясняет, почему ГЭФ не находят на ранних сроках беременности, ведь минерализация набирает обороты именно во втором триместре.
Есть еще одна причина, по которой может обнаруживаться участок ГЭФ в предсердии – наличие определенных включений в самой структуре сердечной мышцы. Нередко именно так на УЗИ видятся дополнительные или ложные хорды. Эти участки соединительной ткани обычно очень тонкие, и если обнаруживаются дополнительные хорды, они вполне могут стать заметными. Такое бывает у множества людей на планете. Сами по себе ложные, дополнительные хорды не представляют опасности для жизни и здоровья ребенка, они никак не нарушают функций детского сердечка. В лечении это не нуждается.
Какие симптомы у врожденного порока сердца?
Первичные дефекты – ДМПП и ДМЖП – часто хорошо видны при УЗИ еще во время беременности. Вторичные, как правило, выявляются после рождения. Специалист их заподозрит при прослушивании тонов сердца, выявит при помощи ЭКГ и ультразвукового исследования.
Важно!
Не всегда аномалии строения сердца «шумят». Но и далеко не все шумы в сердце – повод для беспокойства.
Например, часто у детей выявляют ложные хорды. Они дают дополнительные звуки, но в большинстве случаев абсолютно безопасны.
Родители могут заподозрить аномалию по симптомам. Хотя все перечисленные пороки относятся к разным структурам сердца, они все вызывают перегрузку малого круга кровообращения. И потому признаки их похожи.
Основные признаки избыточной нагрузки на правые отделы сердца – учащение дыхания, ускоренное сердцебиение, наличие отеков, недостаточное выделение мочи.
У малыша можно заметить посинение кончиков пальцев, мочек уха, кончика носа, цианоз щек.
Важно также в младенчестве обращать внимание на то, как малыш ест: при выраженном пороке сердца такая нагрузка быстро приводит к усталости, и ребенок отказывается от еды. Из-за чего прибавки в весе не соответствуют нормам.
Врожденные пороки сердца предрасполагают к частым ОРВИ со вторичным наложением бактериального воспаления, например, бактериальный бронхит после гриппа.
На данный момент золотой стандарт диагностики врожденных пороков сердца – УЗИ
Это исследование показано всем детям в 1 месяц в рамках плановых осмотров. Кроме УЗИ назначают также ЭКГ, при необходимости – рентгенографию легких и так далее.
На данный момент золотой стандарт диагностики врожденных пороков сердца – УЗИ. Это исследование показано всем детям в 1 месяц в рамках плановых осмотров. Кроме УЗИ назначают также ЭКГ, при необходимости – рентгенографию легких и так далее.
Важно!
Практически у всех малышей первых месяцев жизни отмечается посинение носогубного треугольника во время плача, которое проходит, как только ребенок успокоится. Это возрастная норма. Однако если это происходит в состоянии покоя, или слишком часто, или вас что-то тревожит – обратитесь к врачу.
Президент Ассоциации детских кардиологов РФ М.А. Школьникова советует родителям, которые столкнулись с диагнозом врожденного порока сердца у ребенка, книгу Г.Э. Фальковского и С.М. Крупянко «Сердце ребенка». Это специально подготовленное экспертами издание свободно распространяется через интернет.
О том, что выяснили ученые в последние годы о причинах врожденных пороков сердца, подробно мы рассказываем в статье про новые исследования в этой области.
Использованы фотоматериалы Shutterstock
Гепатоцеллюлярная аденома (ГЦА)
Гепатоцеллюлярная аденома (ГЦА). ГЦА считается редко встречающейся доброкачественной опухолью, происходящей из гепатоцитов. Имеются предположения о влиянии на развитие и рост опухоли пероральных контрацептивов, экзогенных андрогенов, беременности и дисбаланса эндогенных половых гормонов. Приводятся противоречивые данные по размерам аденом – указываются цифры от 1 до 19 см, составляя в среднем 5,4 см. В некоторых случаях у пациентов отмечаются множественные аденомы. Образования хорошо очерчены. Ряд авторов отмечает характерные отличительные признаки аденом – в отличие от гемангиом они не располагаются рядом с печеночными сосудами, не занимают целую долю. Течение ГЦА в большинстве случаев бессимптомное. При размерах опухоли от 5 см и более или субкапсулярным ее расположении риск кровотечения увеличивается
Авторы подчеркивают практическую важность диагностики аденомы из-за высокого риска развития кровотечения, разрыва, малигнизации и необходимости выполнения хирургического вмешательства
При УЗИ ГЦА обычно выглядит как солитарное гетерогенное образование с четкими контурами различной степени эхогенности: 20-40% аденом представляются гипоэхогенными, 30% – гиперэхогенными, что обусловлено наличием жировых включений в тканях опухоли. По мнению ряда авторов, при использовании ЦДК в ряде случаев выявляются периферические пери- и интратуморальные сосуды.
Аденома печени
Таким образом, УЗИ органов брюшной полости в настоящее время является скрининговым методом выявления опухолей и опухолеподобных процессов печени. Благодаря достаточно высокой информативности и доступности УЗИ выполняется на первом этапе диагностики при подозрении на новообразование печени. УЗИ позволяет не только выявить опухоль в печени, но и судить о ее размерах, топографии, операбельности процесса. Интраоперационное УЗИ информативно для диагностики внутрипеченочных опухолей, поскольку во время операции другие методы исследования мало применимы.
УЗИ в режиме «серой шкалы» позволяет выявить различные изменения в паренхиме. Однако в ряде случаев провести дифференциальную диагностику между диффузными заболеваниями не представляется возможным из-за схожести эхографических признаков.
Эхография в В-режиме с допплерографией сосудистой системы печени с оценкой состояния гемодинамики позволяет уточнить характер патологического процесса. Однако, несмотря на высокую специфичность (97%), чувствительность метода в выявлении опухолей печени остается достаточно низкой (60%), что позволяет отдавать предпочтение динамическим методикам РКТ или МРТ. Кроме того, по мнению отдельных исследователей, информативность диагностического заключения УЗИ, как субъективного метода исследования, зависит от опыта и квалификации врача УЗ диагностики.